溃疡性结肠炎(UC)是一种病因不明的肠道慢性炎症性疾病。多糖是黄蜀葵花最重要的活性成分之一,具有抗氧化和免疫调节等多种药理活性。然而,目前还没有研究报道黄蜀葵花多糖(ACP)在治疗UC中的应用。本研究旨在强调ACP治疗UC的疗效,并揭示其潜在机制;使用葡聚糖硫酸钠(DSS)诱导的结肠炎模型初步验证了潜在的治疗效果;使用粪便样本进行16S rRNA测序,使用血清样本进行非靶向代谢组学分析,以进一步揭示ACP重编程UC进展引发的生态失调,在属水平上增加拟杆菌属、Blautia spp.和Parabacteroides spp.的丰度,并提高7-酮脱氧胆酸(7-KDA)的血清浓度。此外,我们使用FXR-/-小鼠模型,发现法尼醇X受体(FXR)是ACP和代谢产物7-KDA的关键靶点,通过修复肠屏障来阻断STAT3磷酸化,从而减轻UC。综上所述,这项工作强调了ACP对UC的治疗潜力,主要通过调节肠道微生物群和调节FXR/STAT3信号通路发挥其作用。
译名:黄蜀葵花多糖和相关代谢产物通过调节肠道微生物群和调节FXR/STAT3信号通路改善结肠炎
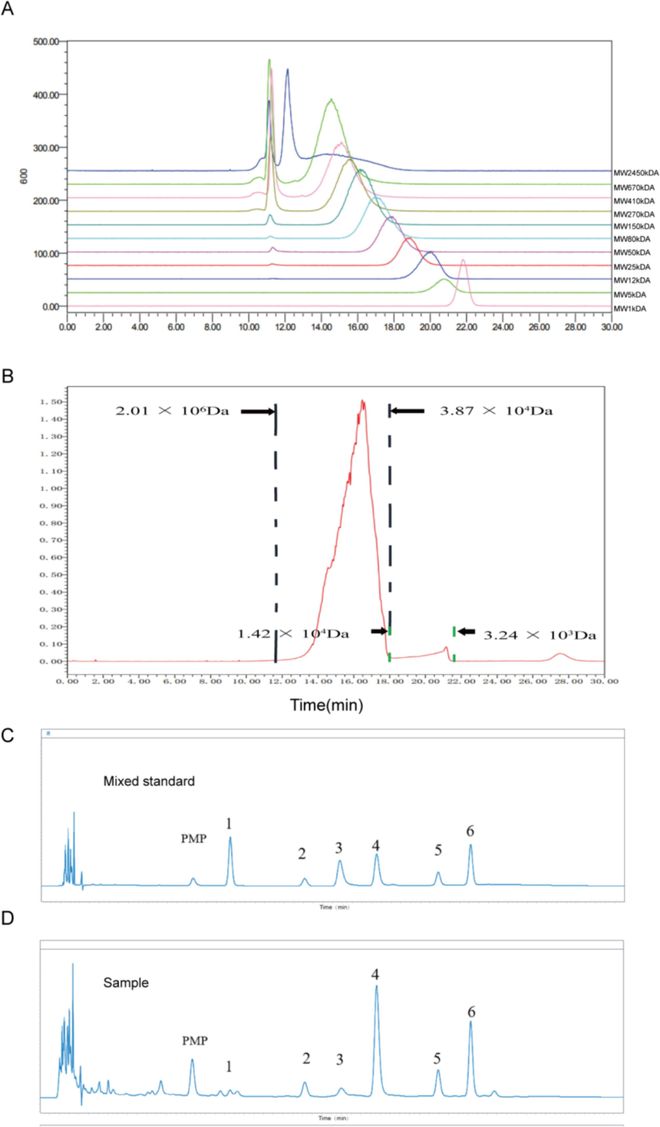
图1 ACP结构特征。(A)叠加标准品色谱图;(B)样品色谱图;(C)单糖标准品色谱图;(D)单糖样品色谱图。1: Man;2: Rha;3: GlcA;4: GalA;5: Glc;6: Gal。
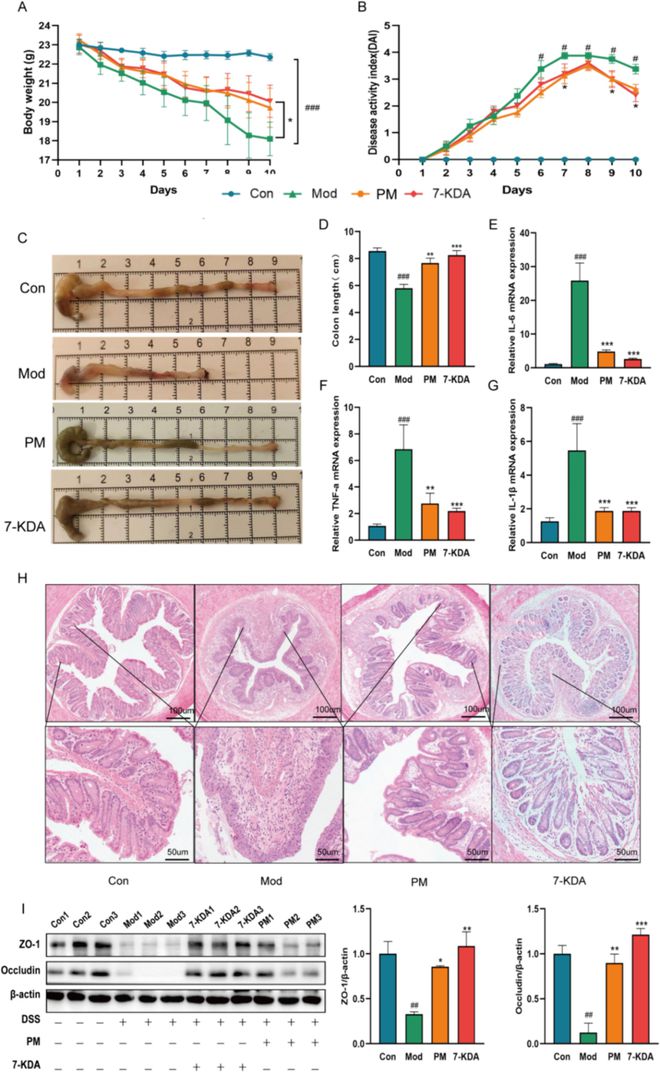
DSS诱导的小鼠结肠炎的临床和组织学特征与人类IBD非常相似,特别是溃疡性结肠炎(UC),表现为体重减轻、腹泻、血便和结肠长度缩短。这些相似之处突显了DSS诱导的小鼠结肠炎作为研究UC模型的相关性。为了评估ACP对结肠炎的保护作用,我们在DSS干预期间每天监测和记录小鼠的体重和DAI评分(图2A-B),小鼠DAI评分细则如表1所示。对照组未见异常。相比之下,DSS组从干预后第三天开始体重逐渐下降,伴有腹泻、血便、嗜睡、食物摄入减少和活动减少等症状。与DSS组相比,给药组和5-ASA组的症状均有显著改善,尤其是中剂量ACP组。此外,ACP有效地增加了结肠长度(图2C-F),受DSS的影响,并减少了脾脏重量(图2G)。H&E染色后(图2H),DSS组的结肠结构显示紊乱、隐窝破坏、杯状细胞计数显著减少,侵入肠黏膜和肌肉层的炎性细胞浸润增加。相比之下,与DSS组相比,给药组和5-ASA组的炎性细胞浸润较低,结肠结构更清晰、更完整,隐窝恢复,杯状细胞丰富,没有溃疡,也没有炎性细胞渗透。促炎细胞因子(IL-6、IL-1β、TNF-α)的过量产生(图2I-K)是结肠炎的一个特征,在DSS诱导的结肠炎小鼠模型中,这些促炎因子的表达水平显著升高,但在所有给药组中都显著降低(图2I-K)。这些结果表明,ACP可以有效缓解DSS诱导的实验性结肠炎,改善肠道结构,减少细胞促炎因子的表达。引物序列见表2。
DSS诱导的结肠炎中,ACP处理会改变基因表达,表现为amine oxidase copper -containing 1(AOC1)基因的活性降低(图3A-C)。AOC1编码的二胺氧化酶(DAO)的浓度是肠屏障破坏的指标之一。DSS组血清DAO、D-乳酸(D-LA)、髓过氧化物酶(MPO)和IL-17的含量显著增加(图3D-G)。与此同时,ACP组和5-ASA组的血压下降,与对照组相比没有统计学上的显著差异。MPO、D-LA和DAO的高水平表明肠道屏障被破坏,肠道通透性增加。肠道紧密连接的蛋白质印迹分析显示,对照组和给药组的结肠紧密连接蛋白ZO-1和Occludin的表达明显高于DSS组(图3H)。进一步的免疫组织化学分析显示,DSS组中ZO-1、Occludin和Muc2等紧密连接的表达降低,但中剂量(PM)组中这些表达增加(图3I)。这些结果共同表明,ACP可能通过增加紧密连接蛋白的量来改善小鼠的肠道损伤,缓解肠道屏障功能障碍。
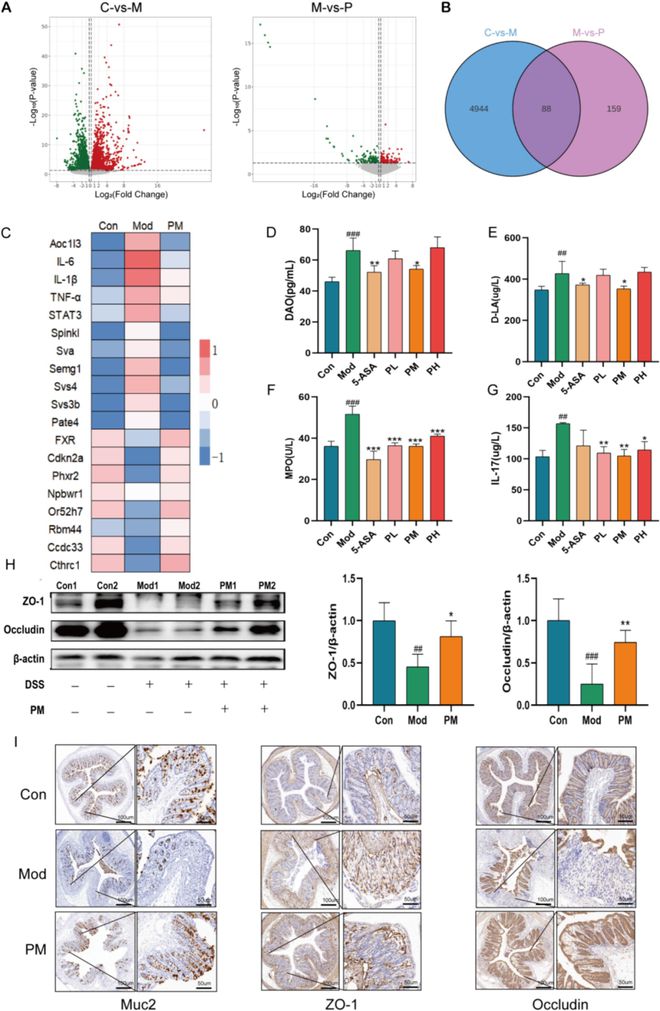
图3 ACP修复DSS诱导的结肠炎中的肠屏障。(A)基因火山图。(B)基因维恩图。(C)基因热图。(D-G)血清MPO、D-LA和DAO水平。(H)是肠道中紧密连接蛋白的蛋白质表达。(I)通过免疫组织化学方法测定。数据以SEM(n=8)的平均值表示,与对照组相比,#P0.05,##P0.01,###P0.001;与DSS组相比,*P0.05,**P0.01,***P0.001。
肠道微生物群被认为是影响UC发展的最相关的环境因素之一。在炎症期间,肠道微生物群的生活环境被破坏,影响其结构和功能,导致生态失调,进一步加剧炎症过程,增加各种慢性疾病的发病率和死亡率。在本研究中,肠道微生物群16S rDNA基因V3-V4区的高通量测序表明,DSS诱导的结肠炎小鼠的肠道微生物群在多样性和组成方面与对照组小鼠存在显著差异。PCA分析结果显示,对照组和DSS组之间存在差异,在结肠炎小鼠接受ACP干预后,我们观察到部分校正的趋势(图4A)。α多样性指数和β多样性指数显示,ACP组的Chao1、Shannon、ACE指数、肠道微生物群的丰度和均匀性均高于DSS组,使其更接近对照组水平(图4B-F)。图4G和H显示了门水平微生物群落结构的分析。结果表明,鉴定出的微生物主要来自厚壁菌门、疣微菌门、拟杆菌门和变形杆菌门,其中厚壁菌属占微生物的最大比例。为了进一步探索肠道微生物群,我们选择了DSS和ACP组中的优势物种,并在属水平上进行了分析。如图4I所示,与DSS组相比,ACP组中拟杆菌属、Blautia spp.和Parabacteroides spp.的相对丰度显著增加,而Lachnospiraceae bacterium A2 spp.和Acutalibacter muris spp.的相对丰富度显著降低。因此得出结论,ACP调节结肠炎小鼠的肠道微生物群紊乱。
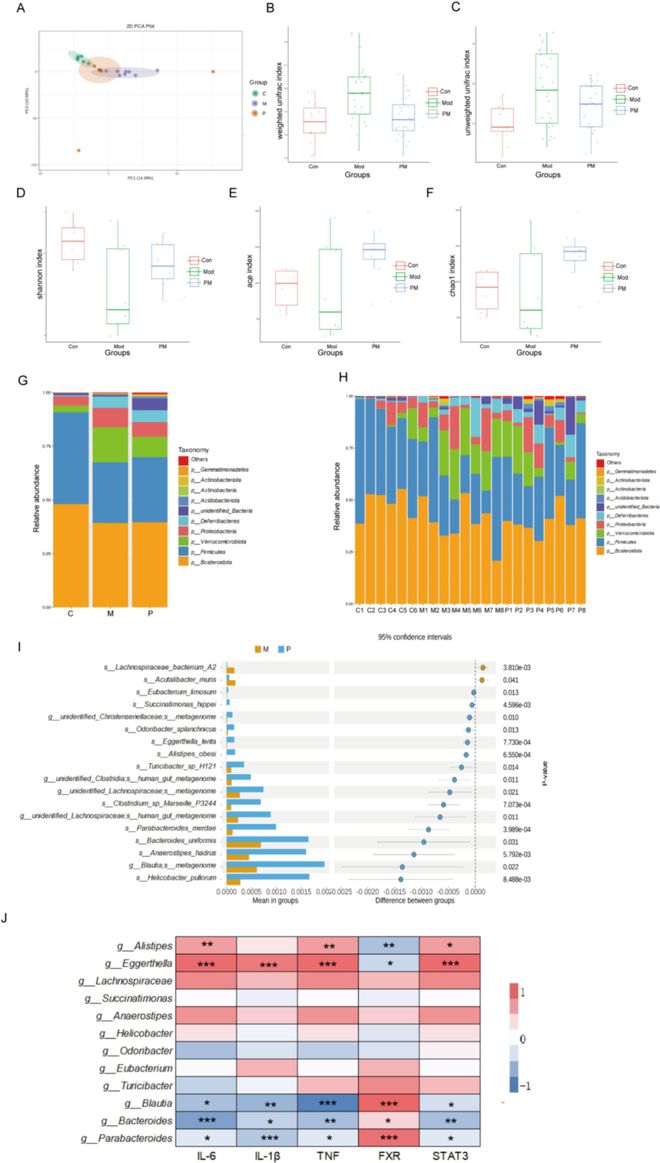
图4 ACP重新编程的肠道微生物群。(A)PCA分析;(B)加权unifrac指数;(C)非加权unifrac指数;(D-F)alpha多样性分析,包括Shannon、ACE和Chao1;(G-H)门水平物种的相对丰度显示;(I)属水平物种的相对丰度显示;(J)肠道细菌与基因的相关性分析。
此外,我们采用Spearman的相关性分析来破译本节中提到的调节性肠道微生物与细胞因子(IL-1β、TNF-α、IL-6)、FXR和STAT3水平之间的关系。如图4J所示,我们筛选了DSS和ACP处理后出现显著变化的肠道微生物群。其中,五种类型与ACP对细胞因子、FXR和STAT3的调节作用显著相关。迄今为止,许多研究已经调查了肠道微生物,如拟杆菌属、Blautia spp.和Parabacteroides spp.,通过减少相关的肠道炎症因子对结肠炎的影响。拟杆菌在结肠炎中的潜在作用已被证明与多糖的抗炎和免疫调节作用显著相关,多糖可能是未来治疗UC的关键微生物群。
我们采用UPLC-QTOF-MS技术检测小鼠血清中的代谢物。PCA分析揭示了对照组和DSS组之间代谢组学特征的明显分离和显著变化。相比之下,在ACP处理后,与DSS组相比,我们发现了明显的回归趋势(图5A)。此外,火山图显示了代谢组学的改变,在筛选过程中,我们在对照组和DSS组之间共鉴定出24种差异代谢物,DSS组和ACP组之间共观察到24种差异代谢产物(图5B-C)。如图5D所示,代谢产物含量差异的动态分布,7-KDA在DSS和ACP给药组中显示出最显著的变化(图5E),表明ACP可能通过改变代谢在缓解UC方面发挥作用。因此,7-KDA的疗效值得进一步研究。
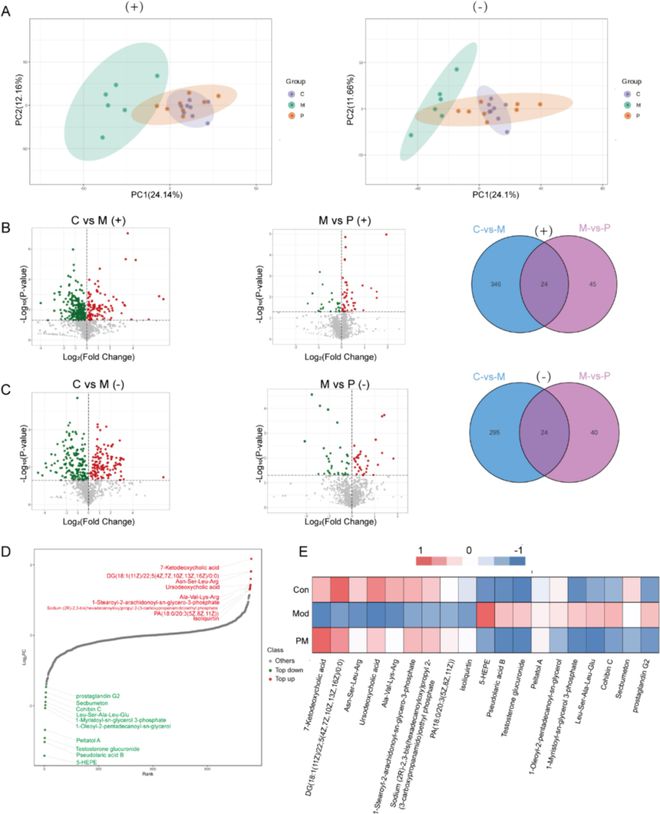
图5 ACP恢复内源性代谢,增加7-酮脱氧胆酸含量。(A)(+)正离子模式;(−)负离子模式;主成分分析;(B)火山图(红色:上调;绿色:下调);(C)维恩图;(D)代谢物含量差异的动态分布;(E)热图显示代谢物的变化。
我们给结肠炎小鼠服用7-KDA作为药物。结果表明,7-KDA有效减轻了结肠炎小鼠的体重减轻(图6A),改善了粪便潜血,降低了DAI评分(图6B)太阳成集团tyc45668cn。与ACP类似,7-KDA减少了结肠长度的减少(图6C-D),并降低了促炎细胞因子如IL-6、IL-1b和TNF-a的表达(图6E-G)。H&E染色(图6H)表明,7-KDA改善了DSS引起的结肠损伤,恢复了肠绒毛和隐窝的结构,增加了杯状细胞的数量,保护了肠黏膜,并增强了紧密连接蛋白ZO-1和Occludin的蛋白表达(图6I)。总体而言,我们的实验证实,7-KDA可以增加肠道紧密连接蛋白的含量,修复肠道屏障,降低炎症因子的表达,缓解结肠炎。
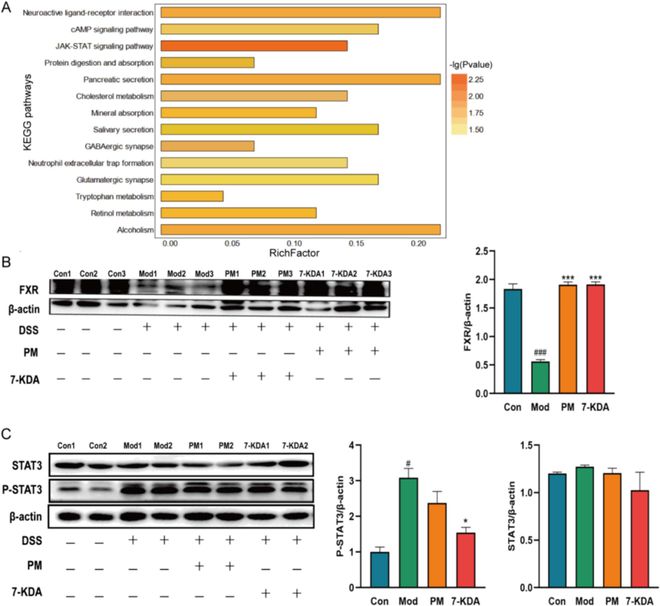
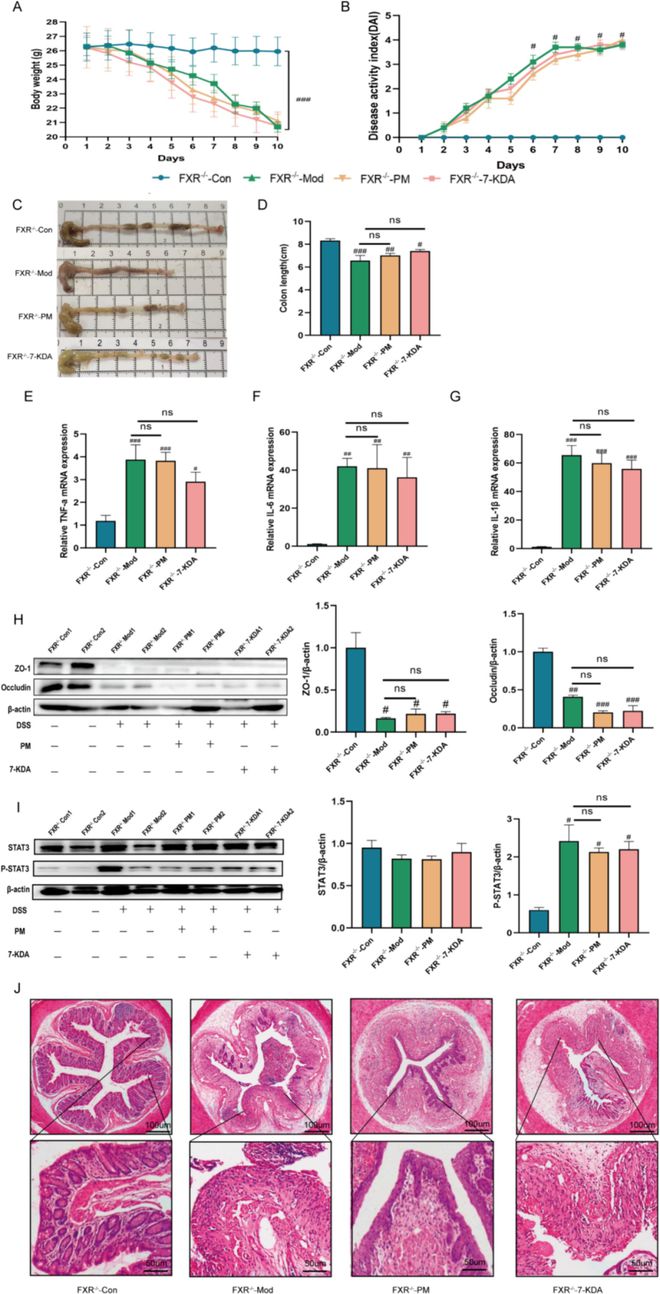
通过进行RNA-seq转录组学分析,我们发现ACP可以上调FXR基因的表达。蛋白质印迹证实,ACP可以提高FXR的蛋白质表达水平(图7B),而7-KDA作为脱氧胆酸,可以自然激活FXR受体。KEGG富集分析(图7A)显示,用ACP处理的结肠炎小鼠的基因变化主要集中在JAK-STAT3信号通路,该通路通过抑制STAT3磷酸化来调节炎症(图7C)。研究表明,FXR受体的激活和表达可以通过拮抗STAT3信号通路和维持肠道微生物组稳态来发挥抗炎作用。因此,我们感兴趣的是ACP和7-KDA是否可以通过激活FXR和抑制STAT3磷酸化来维持肠上皮屏障的完整性,从而减轻炎症并增强黏膜屏障防御。我们在FXR基因敲除C57BL/6 R J小鼠中建立了急性溃疡性结肠炎模型,并通过灌胃给予ACP和7-KDA。结果表明,喂食ACP和7-KDA对FXR−/-小鼠没有治疗作用,体重减轻(图8A)、粪便血、DAI评分(图8B)或结肠缩短(图8C)与DSS组一致。此外,炎症因子表达水平没有降低(图8E-G)。H&E图像(图8J)显示,DSS和处理组的结肠组织结构紊乱,隐窝破坏,杯状细胞减少,炎性细胞浸润。与对照组相比,DSS组和给药组的ZO-1和Occludin紧密连接蛋白表达均降低(图8H),而P-STAT3蛋白表达增加(图8I)。这些发现证实,ACP及其代谢产物7-KDA可以激活FXR并抵消STAT3磷酸化,FXR是ACP治疗UC的关键靶点。
多糖是一类通过糖苷键连接的天然聚合物,广泛存在于中草药的水提取物中。黄蜀葵花是黄蜀葵的一种著名草药提取物,含有多种活性成分,包括多糖和黄酮类化合物。在我们之前的研究中,黄蜀葵花总黄酮被证实可以通过促进阿克曼菌的生长和修复结肠炎小鼠受损的肠屏障来治疗UC。此外,多项研究表明,黄蜀葵花对UC有改善作用。ACP是黄蜀葵花最重要的活性成分之一。然而,ACP在治疗UC中的应用尚未有报道,ACP是否具有抗结肠炎作用也迫切需要进一步研究。为了弥补这些不足,我们进行了这项研究,以探索ACP对UC的积极影响及其背后可能的分子机制。我们证明口服ACP能有效抑制DSS小鼠的UC炎症,因为它们表现出减轻体重、降低疾病活动指数和降低促炎细胞因子水平。
肠道微生物群被认为是影响UC发展的最相关的环境因素之一。最近,有报道称多糖具有调节肠道微生物生态的能力。有趣的是,我们在ACP处理的小鼠中观察到肠道微生物群的显著变化。16S rRNA测序结果显示,拟杆菌属、Blautia spp.和Parabacteroides spp.在这些小鼠中显著富集。先前的研究表明,拟杆菌可以抑制IBD模型中的炎症,增加肠黏膜屏障功能,减少NF-κB信号在肠上皮细胞中的传递,改善UC的症状。据报道,拟杆菌与肠道脱氧胆酸有着千丝万缕的联系,增加了脱氧胆酸的含量,并将胆酸和鹅脱氧胆酸转化为7-KDA。Blautia是一种存在于哺乳动物粪便和肠道中的益生菌厌氧菌属,具有生物转化、调节宿主健康和缓解代谢综合征的能力。研究强调了Blautia缓解炎症和代谢性疾病的能力及其对特定微生物的独特抗菌活性。拟杆菌属中Parabacteroides merdae(已被发现是UC的潜在生物标志物)的缺失可能会加剧UC严重程度。此外,我们通过Spearman相关性分析验证了这三种肠道细菌与细胞因子(IL-1β、TNF-α、IL-6)、FXR和STAT3水平之间的相关性。与文献一致,拟杆菌属、Blautia spp.和Parabacteroides spp.能够显著降低结肠炎中的细胞因子水平,并增加FXR的表达水平。
肠道微生物可以产生各种代谢物,如短链脂肪酸(SCFA)和色氨酸衍生物,这些代谢物对于调节多种宿主微生物组途径至关重要。因此,我们使用血清样本进行了非靶向UPLC-MS代谢组学,以鉴定与ACP抗结肠炎益处相关的差异代谢物。ACP处理显著富集了BAs代谢途径的重要代谢中间体7-KDA。7-KDA是由肠道微生物群产生的胆汁酸衍生物,能够激活FXR。这种分子具有广泛的生物学特性,包括抗炎、抗氧化、抗肿瘤和免疫调节作用。根据现有文献,7-KDA可以由拟杆菌属、Parabacteroides、Clostridium absonum、乳杆菌和双歧杆菌产生。如图4I所示,与模型结肠炎小鼠相比,ACP喂养的小鼠中拟杆菌和Parabacteroides的丰度显著增加,同时7-KDA代谢物的血清浓度升高。因此,我们推测ACP通过增加拟杆菌和Parabacteroides的丰度来增加7-KDA含量,从而改善UC。
BA不仅是消化表面活性剂,也是重要的细胞信号分子。BA代谢异常与肝损伤、代谢紊乱、心血管疾病和消化系统疾病(如UC和结直肠癌癌症)有关。FXR属于核受体家族中的代谢受体亚类,BA已被鉴定为具有高亲和力的内源性FXR配体。FXR可以被游离BA和共轭BA激活。最近,FXR通过调节炎症反应的程度、维持肠屏障的完整性和功能以及防止肠道细菌移位,在许多方面与减轻炎症和保持肠上皮屏障的完整有关。如图3所示,mRNA-seq结果表明模型小鼠FXR mRNA表达显著降低,而ACP可以显著增加FXR的表达,表明其在体内促进FXR激活的能力。先前的研究报告称,FXR配体通过拮抗其他信号通路发挥抗炎活性,部分是通过与其他转录因子的相互作用,包括信号转导子和转录激活子3(STAT3)。因此,我们在图3中观察到STAT3在模型小鼠中高度表达,但在ACP处理后显著降低;我们推测ACP可能通过7-KDA代谢的FXR/STAT3信号通路发挥抗结肠炎作用。为了验证我们的假设,我们分别给FXR-/-模型小鼠喂食ACP和7-KDA,我们的结果证实FXR是结肠炎小鼠的关键靶点。本研究初步验证了ACP和7-KDA通过抑制FXR阻断STAT3激活的机制。如上所述,我们可以得出结论,ACP对UC的治疗作用可能是通过调节肠道微生物群及其代谢产物7-KDA介导的(图9)。
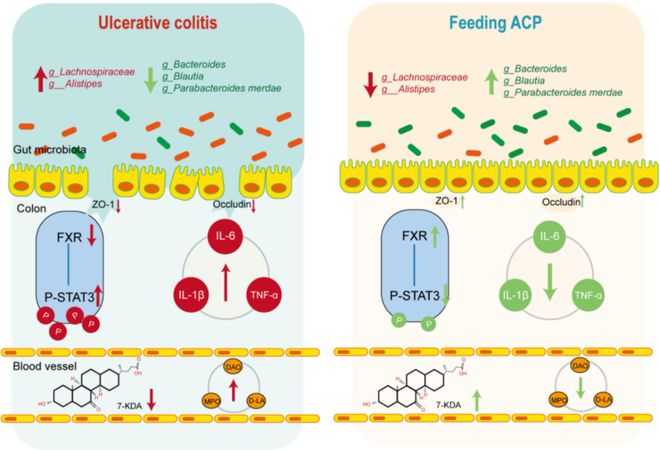
图9 ACP及其相关代谢产物7-KDA通过肠道微生物群和调节FXR/STAT3信号通路改善结肠炎。
这项研究不可避免地存在一定的局限性。首先,ACP的结构表征不够全面。其次,负责产生7-KDA的特定细菌尚未确定,它们之间的因果关系仍有待证实。这些差距应在未来的研究中加以解决。
综上所述,ACP的抗结肠炎作用最初在我们的DSS模型中得到了验证。此外,我们的研究首次全面揭示了ACP对UC的治疗作用,表明血清代谢物7-KDA的增加可能是治疗UC的关键因素。此外,7-KDA介导的FXR/STAT3信号通路的调节可能是ACP抗结肠炎益处的原因。我们的研究强调了ACP对UC的治疗潜力,主要是由于其通过调节肠道微生物群和调节7-KDA的产生而具有抗结肠炎作用。
【福利时刻】科研服务(点击查看):、、、、、。咨询加微信:1278317307。
特别声明:以上内容(如有图片或视频亦包括在内)为自媒体平台“网易号”用户上传并发布,本平台仅提供信息存储服务。
浙大今天开学,有家长从河南拉来了定制的床垫枕头:儿子从未出过远门,提前准备了一个多星期……
歼20产量已超300架!韩媒:1000架歼20也不敌F35,只在无力呐喊
副局长接受老板宴请并饮酒,餐后又接受唱歌娱乐活动,被降级!局长被诫勉!
TTS新传论文带读:这篇论文的作者看了8年“精神小伙”直播(牛啊...
与中坚力量共成长,2024建信信托艺术大奖评委会特别奖获奖艺术家凌海鹏